Científicos enseñan a bacterias el secreto del pulpo para camuflaje
Un equipo de la Universidad de California en San Diego desarrolló un método para que bacterias generen xanthommatin, el pigmento que permite a pulpos y calamares camuflarse, revolucionando la biotecnología.
03/11/2025 | 15:25Redacción Cadena 3
Investigadores de la Universidad de California, San Diego lograron un avance significativo en la comprensión de una de las habilidades más fascinantes de la naturaleza: el arte del camuflaje. Los pulpos, calamares y sus parientes cefalópodos son maestros en esta técnica, capaces de cambiar instantáneamente el color de su piel para mezclarse con su entorno. Esta extraordinaria transformación es impulsada por un pigmento natural llamado xanthommatin, que juega un papel clave en su piel cambiante.
Durante años, tanto investigadores como organizaciones de defensa han estado cautivados por las cualidades sensibles a la luz de este pigmento. Sin embargo, replicar y estudiar el xanthommatin en el laboratorio había resultado extremadamente desafiante, hasta ahora.
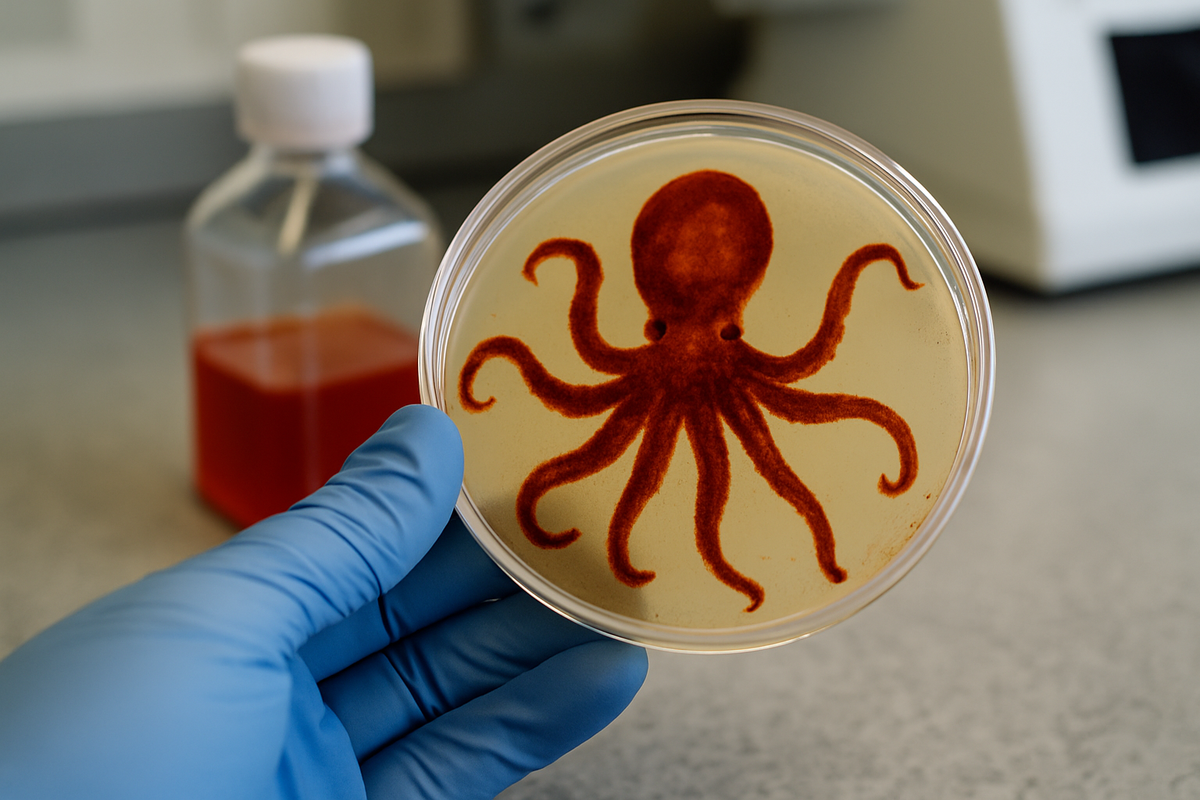
En un nuevo avance del Scripps Institution of Oceanography de la UC San Diego, los científicos desarrollaron un método para producir grandes cantidades de xanthommatin, lo que representa un gran paso adelante en la comprensión de cómo los animales logran su notable camuflaje.
Bacterias convertidas en fábricas de pigmento natural
Utilizando un enfoque biológicamente inspirado, el equipo de investigación generó el pigmento dentro de bacterias, alcanzando niveles de producción hasta 1,000 veces mayores que los métodos anteriores. Esta innovación podría abrir el camino a nuevos usos sostenibles en materiales y cosméticos, incluyendo aplicaciones en fotoelectrónica, recubrimientos térmicos, tintes y productos protectores contra UV.
"Hemos desarrollado una nueva técnica que ha acelerado nuestras capacidades para fabricar un material, en este caso xanthommatin, en una bacteria por primera vez", afirmó Bradley Moore, autor principal del estudio y químico marino con nombramientos en Scripps Oceanography y la Skaggs School of Pharmacy and Pharmaceutical Sciences de UC San Diego. "Este pigmento natural es lo que le da a un pulpo o a un calamar su capacidad de camuflaje, un superpoder fantástico, y nuestro logro para avanzar en la producción de este material es solo la punta del iceberg."
El estudio, publicado el 3 de noviembre en Nature Biotechnology, recibió apoyo de los Institutos Nacionales de Salud, la Oficina de Investigación Naval, la Fundación Nacional Suiza de Ciencia y la Fundación Novo Nordisk.
Según los investigadores, este logro no solo profundiza nuestra comprensión de las bases biológicas y químicas de la coloración animal, sino que también destaca una nueva biotecnología poderosa. La misma técnica podría utilizarse para crear otros compuestos valiosos, ayudando a las industrias a transitar de productos basados en petróleo hacia materiales más sostenibles e inspirados en la naturaleza.
Un pigmento prometedor
Más allá de los cefalópodos, el xanthommatin también se encuentra en insectos del grupo de los artrópodos, contribuyendo a los brillantes tonos naranjas y amarillos de las alas de la mariposa monarca y los intensos rojos que se observan en los cuerpos de las libélulas y los ojos de las moscas.
A pesar de las fantásticas propiedades colorantes del xanthommatin, su comprensión ha sido limitada debido a un persistente desafío de suministro. La recolección del pigmento de los animales no es escalable ni eficiente, y los métodos tradicionales de laboratorio son laboriosos, dependiendo de la síntesis química que produce bajos rendimientos.
Los investigadores del Moore Lab en Scripps Oceanography buscaron cambiar eso, trabajando con colegas de UC San Diego y del Centro de Biosostenibilidad de la Fundación Novo Nordisk en Dinamarca para diseñar una solución, un tipo de bucle de retroalimentación de crecimiento que llaman "biosíntesis acoplada al crecimiento".
La forma en que bioingeniaron el pigmento del pulpo, un químico, en una bacteria representa un cambio novedoso respecto a los enfoques biotecnológicos típicos. Su enfoque conectó íntimamente la producción del pigmento con la supervivencia de la bacteria que lo fabricó.
"Necesitábamos un enfoque completamente nuevo para abordar este problema", dijo Leah Bushin, autora principal del estudio, ahora miembro del cuerpo docente en Stanford University y anteriormente investigadora postdoctoral en el Moore Lab en Scripps Oceanography, donde se realizó su trabajo. "Esencialmente, encontramos una forma de engañar a las bacterias para que produjeran más del material que necesitábamos."
Normalmente, cuando los investigadores intentan que un microbio produzca un compuesto extraño, esto crea una carga metabólica importante. Sin una manipulación genética significativa, el microbio se resiste a desviar sus recursos esenciales para producir algo desconocido.
Al vincular la supervivencia de la célula a la producción de su compuesto objetivo, el equipo logró engañar al microbio para que creara xanthommatin. Para ello, comenzaron con una célula "enferma" genéticamente modificada, que solo podía sobrevivir si producía tanto el pigmento deseado como un segundo químico llamado ácido fórmico. Por cada molécula de pigmento generada, la célula también producía una molécula de ácido fórmico. El ácido fórmico, a su vez, proporciona combustible para el crecimiento de la célula, creando un bucle autosostenible que impulsa la producción de pigmento.
"Hicimos que la actividad a través de esta vía, de hacer el compuesto de interés, sea absolutamente esencial para la vida. Si el organismo no produce xanthommatin, no crecerá", dijo Bushin.
Para impulsar a las bacterias a producir aún más pigmento, los investigadores recurrieron a la robótica y la automatización. Utilizaron sistemas robóticos para guiar a los microbios a través de dos rondas de evolución adaptativa de laboratorio de alto rendimiento, un proceso diseñado para ayudar a las células a mejorar gradualmente su rendimiento. Este método avanzado fue desarrollado por el laboratorio del coautor del estudio Adam Feist, profesor en el Shu Chien-Gene Lay Department of Bioengineering de la UC San Diego Jacobs School of Engineering y científico senior en el Centro de Biosostenibilidad de la Fundación Novo Nordisk.
Los investigadores también utilizaron software de bioinformática especializado del Feist Lab para identificar cambios genéticos que aumentaron la productividad de los microbios. Estas mutaciones clave permitieron a las bacterias modificadas producir el pigmento de manera eficiente utilizando solo una fuente de nutrientes.
"Este proyecto ofrece un vistazo a un futuro donde la biología permite la producción sostenible de compuestos y materiales valiosos a través de la automatización avanzada, la integración de datos y el diseño impulsado por computación", dijo Feist. "Aquí, mostramos cómo podemos acelerar la innovación en la biomanufactura al reunir ingenieros, biólogos y químicos utilizando algunas de las técnicas de ingeniería de cepas más avanzadas para desarrollar y optimizar un nuevo producto en un tiempo relativamente corto."
Los enfoques tradicionales producen alrededor de cinco miligramos de pigmento por litro "si tienes suerte", dijo Bushin, mientras que el nuevo método produce entre uno y tres gramos por litro.
Pasar de las etapas de planificación a la experimentación real en el laboratorio tomó varios años de trabajo dedicado, pero una vez que el plan se puso en marcha, los resultados fueron casi inmediatos.
"Fue uno de mis mejores días en el laboratorio", recordó Bushin sobre el primer experimento exitoso. "Había configurado el experimento y lo dejé toda la noche. Cuando llegué a la mañana siguiente y me di cuenta de que funcionó y estaba produciendo mucho pigmento, me emocioné. Momentos como ese son la razón por la que hago ciencia."
Próximos pasos
Moore anticipa que esta nueva metodología biotecnológica, que es completamente inspirada en la naturaleza y no invasiva, transformará la forma en que se producen los bioquímicos.
"Realmente hemos interrumpido la forma en que la gente piensa sobre cómo se ingeniaría una célula", dijo. "Nuestro enfoque tecnológico innovador provocó un gran salto en la capacidad de producción. Este nuevo método resuelve un desafío de suministro y podría hacer que este biomaterial esté mucho más disponible en general."
Si bien algunas aplicaciones para este material son aún lejanas, los autores notaron un interés activo por parte del Departamento de Defensa de EE. UU. y empresas de cosméticos. Según los investigadores, los colaboradores están interesados en explorar las capacidades de camuflaje natural del material, mientras que las empresas de cuidado de la piel están interesadas en utilizarlo en protectores solares naturales. Otras industrias ven potenciales usos que van desde pinturas para el hogar que cambian de color hasta sensores ambientales.
"A medida que miramos hacia el futuro, los humanos querrán repensar cómo fabricamos materiales para apoyar nuestro estilo de vida sintético de 8 mil millones de personas en la Tierra", dijo Moore. "Gracias a la financiación federal, hemos desbloqueado un prometedor nuevo camino para diseñar materiales inspirados en la naturaleza que son mejores para las personas y el planeta."
Los autores adicionales del estudio son Tobias Alter, María Alván-Vargas, Daniel Volke, Óscar Puiggené y Pablo Nikel del Centro de Biosostenibilidad de la Fundación Novo Nordisk; Elina Olson del Shu Chien-Gene Lay Department of Bioengineering de UC San Diego; Lara Dürr y Mariah Avila de Scripps Institution of Oceanography en UC San Diego; y Taehwan Kim y Leila Deravi de Northeastern University.
Lectura rápida
¿Qué lograron los investigadores?
Desarrollaron un método para que bacterias produzcan xanthommatin, el pigmento que permite a pulpos y calamares camuflarse.
¿Quiénes realizaron el estudio?
Investigadores de la Universidad de California, San Diego, específicamente del Scripps Institution of Oceanography.
¿Cuándo se publicó el estudio?
El estudio fue publicado el 3 de noviembre de 2025 en Nature Biotechnology.
¿Cómo se logró la producción del pigmento?
Se utilizó un enfoque biológicamente inspirado que vincula la producción del pigmento a la supervivencia de las bacterias.
¿Por qué es importante este avance?
Este avance podría revolucionar la biotecnología, permitiendo la producción sostenible de materiales y compuestos valiosos.