Científicos del MIT desarrollan terapia innovadora contra el cáncer
Investigadores del MIT y Stanford presentaron un enfoque que potencia la respuesta inmune contra células cancerosas. Utilizan moléculas que bloquean un "interruptor" que oculta tumores del sistema inmunológico.
26/12/2025 | 12:17Redacción Cadena 3
Un equipo de investigación del MIT y la Universidad de Stanford desarrolló una técnica innovadora destinada a estimular el sistema inmunológico para atacar células tumorales. Este enfoque busca mejorar la eficacia de la inmunoterapia contra el cáncer, beneficiando a un mayor número de pacientes.
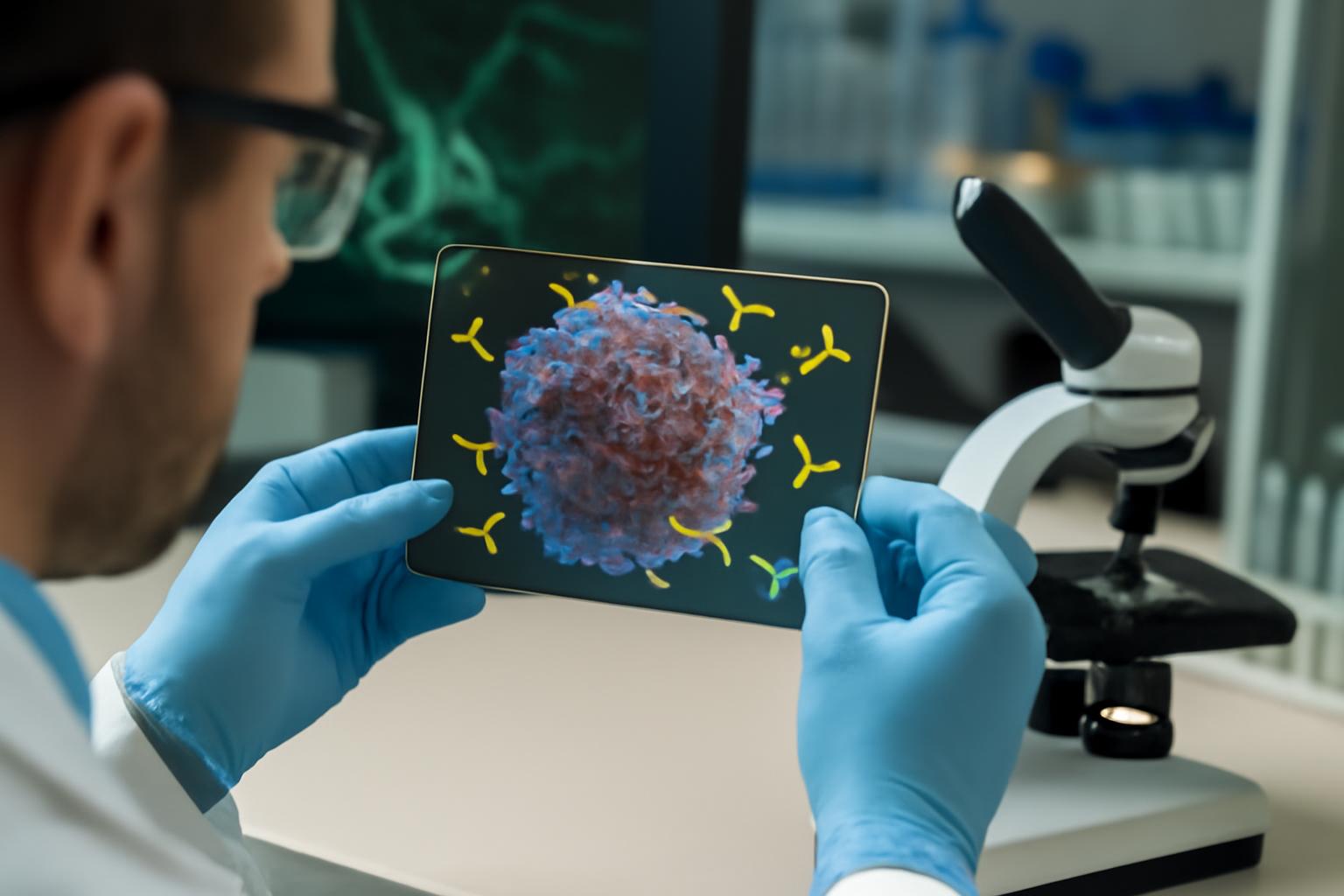
El núcleo de este trabajo radica en desactivar un "freno" que los tumores pueden activar para evitar que las células inmunitarias los ataquen. Este freno está relacionado con azúcares llamados glicanos, que se encuentran en la superficie de las células cancerosas.
Los científicos descubrieron que bloquear estos glicanos con proteínas conocidas como lectinas puede fortalecer significativamente la actividad inmunitaria contra las células cancerosas. Para lograr esto de manera específica, crearon moléculas multifuncionales llamadas AbLecs, que combinan una lectina con un anticuerpo que se dirige a los tumores.
"Creamos un nuevo tipo de terapia proteica que puede bloquear los puntos de control inmunitarios basados en glicanos y potenciar las respuestas inmunitarias contra el cáncer", afirmó Jessica Stark, profesora de desarrollo profesional en los departamentos de Ingeniería Biológica e Ingeniería Química. "Dado que se sabe que los glicanos restringen la respuesta inmunitaria en múltiples tipos de tumores, sospechamos que nuestras moléculas podrían ofrecer nuevas y potencialmente más efectivas opciones de tratamiento para muchos pacientes con cáncer".
Stark, quien también es miembro del Koch Institute for Integrative Cancer Research del MIT, lideró el estudio como autora principal. Carolyn Bertozzi, profesora de química en Stanford y directora del Sarafan ChEM Institute, fue la autora principal del trabajo. Los hallazgos fueron publicados en la revista Nature Biotechnology.
Cómo los tumores utilizan frenos inmunitarios
Uno de los principales objetivos en el tratamiento del cáncer es enseñar al sistema inmunológico a identificar y eliminar las células tumorales. Un grupo importante de medicamentos de inmunoterapia, llamados inhibidores de puntos de control, interrumpe la interacción entre dos proteínas, PD-1 y PD-L1. Al bloquear esta conexión, estos medicamentos eliminan un freno que los tumores utilizan para evitar que células inmunitarias como los linfocitos T maten las células cancerosas.
Los inhibidores de puntos de control que atacan la vía PD-1/PD-L1 ya están aprobados para varios tipos de cáncer. Para algunas personas, pueden producir remisiones duraderas. Sin embargo, para muchos otros, ofrecen poco o ningún beneficio.
Debido a esta brecha, los investigadores buscan otras formas en que los tumores suprimen el sistema inmunológico. Un objetivo prometedor involucra las interacciones entre los glicanos tumorales y los receptores en las células inmunitarias.
Siglecs, ácido siálico y un punto de control basado en azúcares
Los glicanos aparecen en casi todas las células vivas, pero las células cancerosas a menudo llevan versiones que no se encuentran en células sanas. Muchos de estos glicanos específicos de tumores incluyen un bloque de azúcar llamado ácido siálico. Cuando los ácidos siálicos se unen a los receptores de lectina en las células inmunitarias, pueden activar una vía que disminuye la respuesta inmunitaria. Las lectinas que reconocen el ácido siálico se llaman Siglecs.
"Cuando los Siglecs en las células inmunitarias se unen a los ácidos siálicos en las células cancerosas, se frena la respuesta inmunitaria. Esto impide que la célula inmunitaria se active para atacar y destruir la célula cancerosa, de la misma manera que ocurre cuando PD-1 se une a PD-L1", explicó Stark.
Hasta ahora, no existen medicamentos aprobados que apunten directamente a la interacción entre Siglec y ácido siálico, aunque se han explorado muchos enfoques. Una idea ha sido crear lectinas que se unan a los ácidos siálicos y bloqueen su contacto con las células inmunitarias. Sin embargo, esto ha sido complicado porque las lectinas típicamente no se unen con suficiente fuerza para acumularse en grandes cantidades en la superficie de las células cancerosas.
AbLecs combinan anticuerpos y lectinas
Para resolver ese problema, Stark y su equipo utilizaron anticuerpos como vehículos de entrega para llevar más lectinas a los tumores. La porción del anticuerpo se dirige a las células cancerosas, y una vez que llega, la lectina unida puede unirse al ácido siálico. Esto bloquea el ácido siálico de interactuar con los receptores Siglec en las células inmunitarias, lo que levanta el freno inmunitario y permite que células inmunitarias como los macrófagos y las células NK ataquen el tumor.
"Este dominio de unión de lectina típicamente tiene una afinidad relativamente baja, por lo que no se puede usar solo como terapia. Pero, cuando el dominio de lectina se une a un anticuerpo de alta afinidad, se puede llevar a la superficie de la célula cancerosa donde puede unirse y bloquear los ácidos siálicos", comentó Stark.
Un diseño modular probado en células y ratones
Para este estudio, los investigadores construyeron un AbLec utilizando trastuzumab, un anticuerpo que se une a HER2 y está aprobado para tratar cánceres de mama, estómago y colorrectales. Para crear el AbLec, reemplazaron un brazo del anticuerpo con una lectina, eligiendo entre Siglec-7 o Siglec-9.
En experimentos de laboratorio con células cultivadas, este AbLec cambió el comportamiento de las células inmunitarias, impulsándolas a atacar y matar células cancerosas.
El equipo también probó los AbLecs en ratones diseñados para expresar receptores Siglec humanos y receptores de anticuerpos humanos. Después de que los ratones recibieron células cancerosas que formaron metástasis pulmonares, el tratamiento con el AbLec resultó en menos metástasis pulmonares que el tratamiento con trastuzumab solo.
Los investigadores también demostraron que el enfoque es flexible. Podían intercambiar diferentes anticuerpos dirigidos a tumores, como rituximab, que se dirige a CD20, o cetuximab, que se dirige a EGFR. También podían cambiar la porción de lectina para dirigirse a otros glicanos inmunosupresores, o usar anticuerpos que atacan proteínas de puntos de control como PD-1.
"Los AbLecs son realmente plug-and-play. Son modulares", afirmó Stark. "Se puede imaginar intercambiando diferentes dominios de receptores señuelo para dirigirse a diferentes miembros de la familia de receptores de lectina, y también se puede cambiar el brazo del anticuerpo. Esto es importante porque diferentes tipos de cáncer expresan diferentes antígenos, que se pueden abordar cambiando el objetivo del anticuerpo".
Próximos pasos y financiamiento
Stark, Bertozzi y sus colegas lanzaron una empresa llamada Valora Therapeutics para desarrollar candidatos principales de AbLec. Su objetivo es comenzar ensayos clínicos en los próximos dos a tres años.
El financiamiento para el trabajo provino en parte de un Burroughs Wellcome Fund Career Award en la interfaz científica, un Society for Immunotherapy of Cancer Steven A. Rosenberg Scholar Award, un V Foundation V Scholar Grant, el National Cancer Institute, el National Institute of General Medical Sciences, una subvención de descubrimiento biológico de Merck, una beca postdoctoral de la American Cancer Society, y una subvención inicial de Sarafan ChEM-H Postdocs at the Interface.
Lectura rápida
¿Qué desarrollaron los científicos del MIT y Stanford?
Una nueva técnica para ayudar al sistema inmunológico a atacar células cancerosas.
¿Cuál es el enfoque principal de esta investigación?
Desbloquear un "freno" que los tumores utilizan para evitar ser atacados por el sistema inmunológico.
¿Qué son los AbLecs?
Son moléculas que combinan lectinas y anticuerpos para potenciar la respuesta inmunitaria contra el cáncer.
¿Qué resultados se obtuvieron en las pruebas?
Los AbLecs demostraron ser más efectivos que los tratamientos actuales en modelos de laboratorio y en ratones.
¿Cuál es el siguiente paso para esta investigación?
Iniciar ensayos clínicos en los próximos dos a tres años a través de la empresa Valora Therapeutics.